O carbono e a vida: o que é, sua importância
O carbono é elemento químico representado na tabela periódica pela letra C. É um não metal de número atômico 6 e massa aproximada igual a doze. É um elemento fundamental à vida e sua capacidade de se combinar com outros elementos dá uma grande variedade de moléculas orgânicas.
Um ramo de eucalipto pode ser transformado em carvão. Isso é possível graças ao fato de haver muito carbono em sua constituição química. A fabricação de carvão vegetal consiste em retirar água e outras substâncias da lenha, restando quase só carbono.
O carvão mineral é resultado de um processo parecido, mas as árvores que lhe deram origem viveram há cerca de 250 milhões de anos.
Algas e pequenos seres vivos que viveram há aproximadamente 100 milhões de anos deram origem a estruturas folhosas, como folhelho pirobetuminoso, comuns em certos lugares do Brasil.
Esses materiais têm em comum diversas propriedades, como a cor e o fato de serem inflamáveis. Isso decorre também do fato de terem muito carbono em sua constituição.
O carbono e a vida
Embora existam pouco mais de cem elementos químicos naturais na biosfera, só alguns deles têm real importância biológica, ou seja, os seres vivos precisam relativamente de um pequeno número de elementos químicos. Observe a Tabela Periódica na figura abaixo.

Ela apresenta os principais elementos químicos necessários à vida. Veja que certos metais, como manganês, ferro, cobre, zinco e outros (destacados em verde), são essenciais para todos os seres vivos.
Entre os relativamente poucos elementos químicos essenciais à vida, alguns são muito mais necessários do que outros. O elemento químico mais comum nos seres vivos é o carbono (C).
Em certos organismos, por exemplo um pequeno crustáceo, para cada átomo de fósforo existem oitenta átomos de carbono.
Em bactérias, esse número é muito maior e pode chegar a mil átomos de carbono para cada átomo de fósforo! Podemos afirmar, portanto, que, além da água, uma das bases químicas da vida é o elemento químico carbono.
Ele está presente em açúcares, nas proteínas e nas gorduras; portanto, não é difícil entender a razão de se dizer que o carbono é a “espinha dorsal” da vida, e também explicar por que se denomina “Química orgânica” o estudo dos compostos de carbono.
De certa forma, ao estudar Bioquímica (ou “Química dos organismos vivos”), estudam-se as diversas formas pelas quais o carbono se apresenta nos seres vivos.
O carbono e a diversidade molecular dos seres vivos
O carbono faz parte tanto de moléculas pequenas, por exemplo as do CO2 encontrado na atmosfera, quanto de moléculas enormes, como os lipídios, com milhares de átomos.
O átomo de carbono tem propriedades especiais que o tornam muito versátil em ligações com outros átomos. A primeira camada eletrônica que circunda o núcleo do átomo tem dois elétrons, o que é suficiente para estabilizá-la.
Mas a segunda camada eletrônica, que se estabiliza com oito elétrons, tem apenas quatro. Isso significa que o carbono está sempre “disposto” a compartilhar dois pares de elétrons, ou seja, ele tem valência 4: é tetravalente.
Os átomos de carbono comumente compensam os quatro elétrons que faltam em sua última camada eletrônica, compartilhando seus elétrons com os de outros átomos, até completar oito elétrons nessa camada.
Isso representa uma tendência à formação de moléculas longas, pois um átomo de carbono pode se ligar a até quatro outros átomos, incluindo de carbono.
Quando os átomos de carbono se ligam a quatro átomos de hidrogênio, por exemplo, todos se estabilizam. Veja as figura abaixo é assim que se forma a molécula de metano (CH4 ).
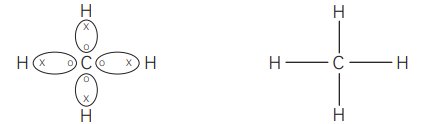
Um átomo de carbono pode formar ligações covalentes com outros átomos de carbono. O esquema da figura abaixo exemplifica as três situações possíveis.
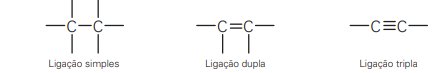
Nas ligações covalentes, os átomos de carbono podem se ligar a outros átomos de carbono em diferentes arranjos: compartilhando apenas um elétron (ligação simples), dois elétrons (ligação dupla), ou até mesmo três elétrons (ligação tripla).
Essa capacidade de os átomos de carbono formarem ligações covalentes com outros átomos, incluindo de carbono, explica sua grande versatilidade para a formação de estruturas moleculares.
Isso possibilita a existência do grande número de moléculas diferentes, indispensáveis aos organismos vivos.
Átomos de carbono que compartilham elétrons com átomos de hidrogênio tendem a se unir e formar um conjunto, como se fossem vagões de um trem
Um átomo de carbono compartilhando elétrons com átomos de hidrogênio e carbono, um de cada lado, estará estabilizado.
O problema dos átomos que funcionam como “vagões do meio do trem” está resolvido, ou seja, eles estão estáveis.
No entanto, restam os átomos de carbono das duas pontas, isto é, os átomos de carbono que têm parceiro apenas de um dos lados.
Esses átomos de carbono são especiais e, por isso, recebem uma designação distintiva, como “alfa” e “ômega” – o primeiro e o último da cadeia, tenha ela quantos átomos tiver.
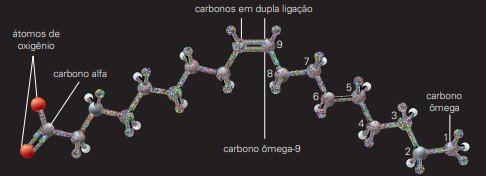
Trata-se do ácido oleico, cuja molécula não é retilínea, devido a uma ligação covalente dupla no nono carbono da cadeia. Tal característica confere uma série de propriedades a outras estruturas, como veremos adiante.
Essa substância é um ácido graxo ômega-9, ou seja, o “cotovelo” de sua molécula está no nono carbono a partir do carbono ômega. Isso explica a facilidade do carbono em formar cadeias lineares longas.
Os átomos de carbono das extremidades “procuram” se estabilizar de diversas formas; por exemplo, combinando-se com átomos de hidrogênio.
Um modo de estabilizar todos os átomos de carbono em uma cadeia longa pode ser a formação de uma dobra, dando à molécula o aspecto de anel.
A mesma cadeia representada pode se estabilizar ao formar um anel. Esses anéis resolvem o problema de estabilidade dos átomos de carbono em certas situações.
É possível perceber como a Geometria molecular é importante na Química orgânica. Adiante você conhecerá três açúcares com mesma fórmula química, mas que formam substâncias diferentes por causa de diferenças em sua geometria molecular.
Os compostos orgânicos moleculares que são importantíssimos para todos os seres vivos conhecidos são, por isso, denominadas biomoléculas.
Resumo
- Poucos elementos químicos são necessários ao metabolismo celular dos seres vivos. Oxigênio, carbono, hidrogênio e nitrogênio, entre outros, são indispensáveis a todos os seres vivos.
- Certos metais, como sódio, potássio, magnésio, cálcio e ferro são importantes para os seres vivos e podem ser obtidos na forma de sais minerais.
- O átomo de carbono é o mais abundante nos seres vivos e estabelece ligações químicas com diversos outros, permitindo a organização de grande variedade de arranjos moleculares, denominados compostos orgânicos.
- carboidratos, proteínas e lipídios, ao lado das vitaminas, são compostos de carbono, componentes básicos do metabolismo celular.
- As moléculas de carboidratos podem ser pequenas, na forma de monômeros, como as pentoses, ou grandes, na forma de polímeros, como a celulose, o amido e o glicogênio. Os dois últimos são importantes moléculas de reserva energética.
Você sabia que tem bastante gente que envia posts, artigos, ou algo qualquer texto relacionado a ciências, educação ou biologia? Você gostaria de participar? Entre em contato.
Se você encontrar algo indevido nos textos, nas imagens, vídeos que recebemos, por favor, relate nos comentários que assim que puder será feita uma revisão.