Água: o solvente universal -> Soluto + solvente = solução
Se você observar uma garrafa de água mineral com gás, você vai ver a formação de um monte de bolhas. Ao ler o rótulo dessa mesma garrafa você verá que não é só gás carbônico que está dissolvida na água. Existem várias outras substâncias. Veja antes uma vídeo aula e um slide sobre o assunto.
Existem três conceitos importantes nessa aula: soluto, solvente e solução. Solutos são substâncias que são dissolvidas na água. Solvente são as substâncias onde o soluto será dissolvido.
Como o tema dessa aula é a água, usaremos sempre ela como exemplo. Mas não se esqueça que há outros solventes além da água. O fato é que a água é conhecida como solvente universal Solução é a mistura do soluto com o solvente. 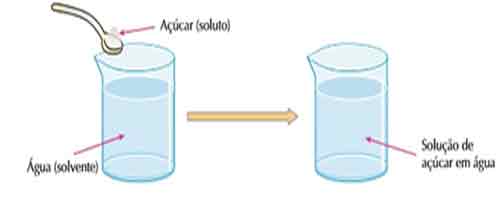 Ao misturar uma colher de açúcar em um copo de água, vai dar a impressão que o açúcar sumiu. Na verdade, o açúcar está dissolvido na água formando uma solução.
Ao misturar uma colher de açúcar em um copo de água, vai dar a impressão que o açúcar sumiu. Na verdade, o açúcar está dissolvido na água formando uma solução.
Se você provar um pouco dessa mistura, vai notar que há um gosto doce nessa água. Se esquentarmos essa mistura a ponto de evaporarmos toda a água o açúcar estará la novamente.
Por ter uma grande capacidade de dissolver diversas substâncias, a água é chamada de solvente universal.
Dê uma olhada na aula Ciclo da água na natureza – fases e processos do ciclo da água Os animais aquáticos conseguem sobreviver na água graças ao oxigênio dissolvido nela. A água do mar é uma solução com diversos solutos dissolvidos.
Fatores que podem facilitar a dissolução
Quando você agitar uma mistura a dissolução ocorre mais rapidamente. A alteração de temperatura e pressão também pode influenciar na capacidade de solutos se dissolverem na água.
Filtração para separar misturas
Você já sabe que a água tem uma grande capacidade de dissolver uma grande quantidade de diferentes substâncias. E por isso ela é chamada de solvente universal. Mas e se quisermos separar a substância que está dissolvida na água? Como podemos fazer isso. Existem vários métodos. Um dos mais simples é a filtração.
Imagine a seguinte situação: uma colher de sal é colocada em um copo de água e agitada até todo o sal ficar dissolvido.
Logo depois, coloca-se grãos de arroz que por sua vez não dissolvem na água.
Para separar o arroz da água é fazer uma filtração. Pode-se fazer com uma peneira ou como na imagem abaixo. Com um suporte com filtro.
Ao passar pelo filtro o arroz ficará retido, mas você provar a água notará que ela possui um gosto salgado.
- O que não estiver dissolvido na água fica retido no filtro.
- O que estiver dissolvido na água passa pelo filtro.
Da mesma forma acontece com o café ou em um filtro de barro que separa partículas sólidas microscópicas da água. Partículas em suspensão são filtradas podem ser separadas através da filtração.
A água que não oferece riscos para a saúde chamamos de água potável.
Classificação dos tipos de água
Podemos classificar a água conforme a quantidade de sais dissolvidos nela. Essa é talvez, a maneira mais conhecida e usada para classificar os tipos de água.
Segundo o Conama (Conselho Nacional do Meio Ambiente), as águas no Brasil podem ser classificadas em:
- Doce: apresenta no máximo 5 gramas de sais dissolvidos por litro de água.
- Salobra: apresenta quantidades entre a 5 gramas a 30 gramas de sais dissolvidos por litro de água.
- Salgada: tem mais do que 30 gramas de sais dissolvidos por litro de água.
Se uma água doce brota de um lençol freático (aquífero), chamamos ela de água mineral. Mesmo no caso desse tipo de água é necessário que se faça uma analise para a verificação de contaminantes sejam biológicos ou de outra origem.
Veja também:
Chamamos de água potável aquela que é a apropriada para o consumo humano. Ela é importante tanto para beber quanto para o preparo de alimentos.
Há casos como a produção de medicamentes em que a água utilizada deve ser destilada, ou seja, uma água sem a presença de sais minerais. Essa água é praticamente pura.
Existe água pura encontrada na natureza?
Podemos considerar que uma água é pura aquela que só possui moléculas de água. Como sua capacidade de dissolver é muito grande ela vai dissolvendo outras substâncias que nela estão, ou por onde a água passa.
Por esse motivo é impossível encontrar água completamente pura na natureza.
A água destilada pode ser obtida utilizando-se equipamentos semelhantes ao da imagem abaixo.
Para a produção de água destilada deve-se aquece-la no balão que ela entre em ebulição. Formará-se um vapor de água que sairá do balão e passará pelo interior de um condensador, onde a água será resfriada por uma outra água fria (de fora do sistema) passando por um tubo externo.
O vapor irá então, se transformar em água líquida destilada, que será recolhida por um frasco de vidro chamado Erlenmeyer.
Resumo da aula Água: o solvente universal
- Porque a água é considerada solvente universal.
- Solvente, soluto e solução.
- Que não são todas as substâncias que podem se dissolver na água.
- A classificação da água quanto à quantidade de sais dissolvidos.
- O processo de filtração.
- A diferença entre água filtrada e água destilada.
Achou algo errado ou indevido? Entre em contato e nos avise!






