O que é glicoproteína: função, estrutura
Glicoproteínas são macromoléculas de proteínas associadas a moléculas de sacarídeos
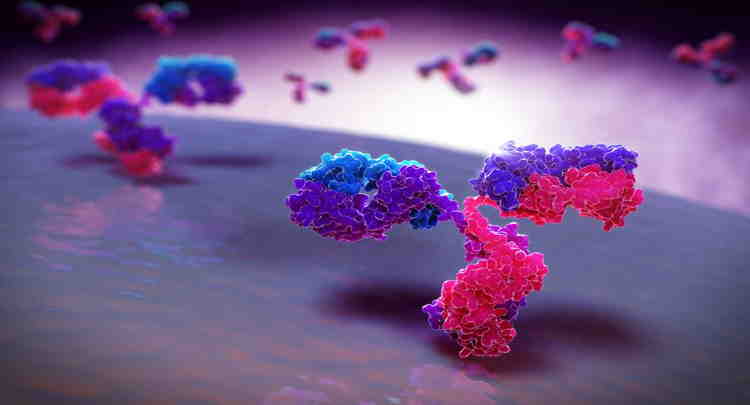
Glicoproteína é um tipo de macromolécula de proteína associada a resíduos de açúcar unidos por ligação covalente. As características hidrofílicas e polares dos açúcares podem alterar drasticamente as características químicas da proteína à qual estão ligadas.
A adição de açúcares é frequentemente necessária para que uma glicoproteína funcione adequadamente e alcance seu destino final na célula ou organismo.
As glicoproteínas estão frequentemente presentes na superfície das células, onde funcionam como proteínas da membrana plasmática ou como parte da matriz extracelular. Essas glicoproteínas da superfície celular desempenham um papel crítico nas interações célula-célula e nos mecanismos de infecção por bactérias e vírus.
Função das glicoproteínas
Podem ter função estrutural, enzimática, lubrificante transportadora e hormonal. Podem ser elementos importantes na composição química das células.
Vários hormônios são formados por glicoproteínas. Por exemplo, hormônios luteinizante, o folículo-estimulante e a gonadotrofina coriônica.
Tipos de glicoproteínas
Existem três tipos de glicoproteínas baseadas em sua estrutura e no mecanismo de síntese: glicoproteínas ligadas a Nitrogênio, glicoproteínas ligadas ao Oxigênio e glicoproteínas não enzimáticas formadas por glicosilação.
As glicoproteínas ligadas ao nitrogênio são sintetizadas e modificadas dentro de duas organelas ligadas à membrana na célula, o retículo endoplasmático rugoso e o aparelho de Golgi.
Formação e estrutura das glicoproteínas
Estruturalmente, uma glicoproteína é formada por uma cadeia polipeptídica, e trechos de oligossacarídeos.
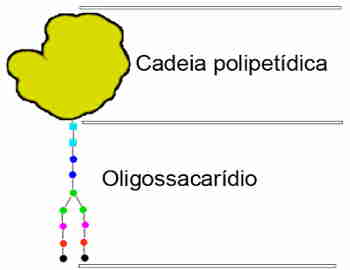
O componente proteico da glicoproteína é montado na superfície do retículo endoplasmático rugoso pela adição sequencial de aminoácidos, criando um polímero linear de chamado polipeptídeo.
Podem ser utilizados vinte aminoácidos diferentes para a síntese de polipeptídeos. A ordem específica dos aminoácidos no polipeptídeo é que determinará sua função e é referida como a sequência de aminoácidos.
Um dos vinte aminoácidos utilizados para a síntese de polipeptídeos, a asparagina (C4H8N2O3), é essencial para a síntese de glicoproteínas ligadas a N (Nitrogênio).
As glicoproteínas ligadas a N têm carboidratos ligados à cadeia lateral R de resíduos de asparagina dentro de um polipeptídeo.
O carboidrato está sempre localizado nas sequências de aminoácidos, onde a asparagina é seguida por algum outro aminoácido e, em seguida, um resíduo de serina ou treonina (-Asn-Xaa-Ser / Thr).
O carboidrato não está ligado ao polipeptídeo. Em vez disso, um grande carboidrato pré-formado contendo catorze ou mais resíduos de açúcar é anexado à asparagina à medida que a proteína está sendo traduzida no retículo endoplasmático rugoso.
O carboidrato da glicoproteína é então modificado por enzimas que removem alguns açúcares e prendem outros à medida que a glicoproteína recém-formada se move do retículo endoplasmático rugoso para o aparelho golgiense e outros locais na célula.
Muitas glicoproteínas ligadas ao N eventualmente se tornam parte da membrana celular ou são secretadas pela célula.
As glicoproteínas ligadas ao O (Oxigênio) são normalmente sintetizadas pela adição de resíduos de açúcar à cadeia lateral hidroxila de resíduos de serina ou treonina em polipeptídeos no aparelho de Golgi.
Ao contrário das glicoproteínas ligadas a N, as glicoproteínas ligadas a O são sintetizadas pela adição de um único resíduo de açúcar de cada vez.
Muitas glicoproteínas ligadas ao O são secretadas pela célula para se tornar parte da matriz extracelular que a cerca.
A glicosilação ou glicação não enzimática cria glicoproteínas pela adição química de açúcares aos polipeptídeos.
Como esse tipo de glicosilação é não enzimático, os fatores que controlam a glicosilação são simplesmente o tempo e a concentração de açúcar. As proteínas mais antigas são mais glicosiladas e as pessoas com níveis circulantes mais altos de glicose experimentam níveis mais altos de glicosilação não enzimática.
Esta é a base do teste de diagnóstico de hemoglobina A1c glicosilada usado para monitorar e manter a longo prazo os níveis de açúcar no sangue em diabéticos.
Leitura sugerida
Você sabia que tem bastante gente que envia posts, artigos, ou algo qualquer texto relacionado a ciências, educação ou biologia? Você gostaria de participar? Entre em contato.
Se você encontrar algo indevido nos textos, nas imagens, vídeos que recebemos, por favor, relate nos comentários que assim que puder será feita uma revisão.
Bibliografia
- CHAUD, Saula Goulart; SGARBIERI, Valdemiro Carlos. Propriedades funcionais (tecnológicas) da parede celular de leveduras da fermentação alcoólica e das frações glicana, manana e glicoproteína. Food Science and Technology, v. 26, n. 2, p. 369-379, 2006.
- Berg, Jeremy M .; Tymoczko, John L .; e Stryer, Lubert (2002). Bioquímica, 5ª edição. Nova York : WH Freeman.
Fonte – Traduzido de:
https://www.encyclopedia.com/science-and-technology/biochemistry/biochemistry/glycoproteins